Reaksi kimia adalah suatu proses alam yang selalu menghasilkan antarubahan
senyawa kimia.
[1] Senyawa ataupun senyawa-senyawa awal yang terlibat dalam reaksi disebut sebagai
reaktan. Reaksi kimia biasanya dikarakterisasikan dengan
perubahan kimiawi, dan akan menghasilkan satu atau lebih
produk
yang biasanya memiliki ciri-ciri yang berbeda dari reaktan. Secara
klasik, reaksi kimia melibatkan perubahan yang melibatkan pergerakan
elektron dalam pembentukan dan pemutusan
ikatan kimia, walaupun pada dasarnya konsep umum reaksi kimia juga dapat diterapkan pada
transformasi partikel-partikel elementer seperti pada
reaksi nuklir.
Reaksi-reaksi kimia yang berbeda digunakan bersama dalam
sintesis kimia untuk menghasilkan produk senyawa yang diinginkan. Dalam
biokimia, sederet reaksi kimia yang
dikatalisis oleh
enzim membentuk
lintasan metabolisme, di mana sintesis dan dekomposisi yang biasanya tidak mungkin terjadi di dalam sel dilakukan.
Persamaan reaksi digunakan untuk menggambarkan reaksi kimia. Persamaan reaksi terdiri dari
rumus kimia atau
rumus struktur
dari reaktan di sebelah kiri dan produk di sebelah kanan. Antara produk
dan reaktan dipisahkan dengan tanda panah (→) yang menunjukkan arah dan
tipe reaksi. Ujung dari tanda panah tersebut menunjukkan reaksinya
bergerak ke arah mana. Tanda panah ganda (

), yang mempunyai dua ujung tanda panah yang berbeda arah, digunakan pada
reaksi kesetimbangan. Persamaan kimia haruslah seimbang, sesuai dengan
stoikiometri,
jumlah atom tiap unsur di sebelah kiri harus sama dengan jumlah atom
tiap unsur di sebelah kanan. Penyeimbangan ini dilakukan dengan
menambahkan angka di depan tiap molekul senyawa (dilambangkan dengan
A, B, C dan
D di diagram skema di bawah) dengan angka kecil (
a, b, c dan
d) di depannya.
[2]

Reaksi
yang lebih rumit digambarkan dengan skema reaksi, tujuannya adalah
untuk mengetahui senyawa awal atau akhir, atau juga untuk menunjukkan
fase transisi.
Beberapa reaksi kimia juga bisa ditambahkan tulisan di atas tanda
panahnya; contohnya penambahan air, panas, iluminasi, katalisasi, dsb.
Juga, beberapa produk minor dapat ditempatkan di bawah tanda panah.
Analisis retrosintetik
dapat dipakai untuk mendesain reaksi sintesis kompleks. Analisis
dimulai dari produk, contohnya dengan memecah ikatan kimia yang dipilih
menjadi reagen baru. Tanda panah khusus (⇒) digunakan dalam reaksi
retro.
[3]
[sunting] Termodinamika
Reaksi kimia dapat ditentukan oleh hukum-hukum
termodinamika. Reaksi dapat terjadi dengan sendirinya apabila senyawa tersebut
eksergonik atau melepaskan energi. Energi bebas yang dihasilkan reaksi ini terdiri dari 2 besaran termodinamika yaitu
entalpi dan entropi]]:
[4]

- G: energi bebas, H: entalpi, T: suhu, S: entropi, Δ: perbedaan
Reaksi eksotermik terjadi apabila ΔH bernilai negatif dan energi dilepaskan. Contoh reaksi eksotermik adalah
presipitasi dan
kristalisasi, dimana sebuah padatan terbentuk dari gas atau cairan. Kebalikannya, dalam reaksi
endotermik,
panas diambil dari lingkungan. Hal ini dapat dilakukan dengan
meningkatkan entropi sistem. Karena kenaikan entropi berbanding lurus
dengan suhunya, maka kebanyakan reaksi endotermik dilakukan pada suhu
tinggi. Kebalikannya, kebanyakan reaksi eksotermik dilakukan pada suhu
yang rendah. Perubahan temperatur kadang-kadang dapat mengubah arah
reaksi, seperti contohnya pada
reaksi Boudouard:

Reaksi antara
karbon dioksida dan
karbon untuk membentuk
karbon monoksida ini merupakan reaksi endotermik dengan suhu di atas 800 °C dan menjadi reaksi eksotermik jika suhunya dibawah suhu ini
[5]
Reaksi juga dapat diketahui dengan
energi dalam yang menyebabkan perubahan pada entropi, volume, dan
potensial kimia.
[6]

- U: energi dalam, S: entropi, p: tekanan, μ: potensial kimia, n: jumlah molekul, d: tanda yang artinya perubahan kecil
[sunting] Pengelompokan reaksi kimia
Beragamnya
reaksi-reaksi kimia dan pendekatan-pendekatan yang dilakukan dalam
mempelajarinya mengakibatkan banyaknya cara untuk mengklasifikasikan
reaksi-reaksi tersebut, yang sering kali tumpang tindih. Di bawah ini
adalah contoh-contoh klasifikasi reaksi kimia yang biasanya digunakan.
[sunting] Empat reaksi dasar
Dalam reaksi
kombinasi langsung atau
sintesis,
dua atau lebih senyawa sederhana bergabung membentuk senyawa baru yang
lebih kompleks. Dua reaktan atau lebih yang bereaksi menghasilkan satu
produk juga merupakan salah satu cara untuk mengetahui kalau itu reaksi
sintesis. Contoh dari reaksi ini adalah gas hidrogen bergabung dengan
gas oksigen yang hasilnya adalah air.
[7]
Contoh lainnya adalah gas nitrogen bergabung dengan gas hidrogen akan membentuk amoniak, dengan persamaan reaksi:
- N2 + 3 H2 → 2 NH3
[sunting] Dekomposisisi
Reaksi
dekomposisi atau
analisis adalah kebalikan dari reaksi sintesis. Sebuah senyawa yang lebih kompleks akan dipecah menjadi senyawa yang lebih sederhana.
[7][8] Contohnya adalah molekul air yang dipecah menjadi gas oksigen dan gas hidrogen, dengan persamaan reaksi:
- 2 H2O → 2 H2 + O2
[sunting] Penggantian tunggal
Dalam
reaksi penggantian tunggal atau
substitusi,
sebuah elemen tunggal menggantikan elemen tunggal lainnya di suatu
senyawa. Contohnya adalah logam natrium yang bereaksi dengan asam
klorida akan menghasilkan
natrium klorida atau garam dapur, dengan persamaaan reaksi:
- 2 Na(s) + 2 HCl(aq) → 2 NaCl(aq) + H2(g)
[sunting] Penggantian ganda
Dalam reaksi penggantian ganda, dua senyawa saling berganti
ion atau ikatan untuk membentuk senyawa baru yang berbeda.
[7] Hal ini terjadi ketika kation dan anion dari 2 senyawa yang berbeda saling berpindah tempat, dan membentuk 2 senyawa baru.
[8] Rumus umum dari reaksi ini adalah:
- AB + CD → AD + CB
Contoh dari reaksi penggantian ganda
adalah timbal(II) nitrat bereaksi dengan kalium iodida untuk membentuk
timbal(II) iodida dan kalium nitrat, dengan persamaan reaksi:
- Pb(NO3)2 + 2 KI → PbI2 + 2 KNO3
Contoh
lainnya adalah natrium klorida (garam dapur) bereaksi dengan perak
nitrat membentuk natrium nitrat dan perak klorida, dengan persamaan
reaksi:
- NaCl(aq) + AgNO3(aq) → NaNO3(aq) + AgCl(s)
[sunting] Oksidasi dan reduksi
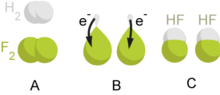
Ilustrasi dari reaksi redoks (reduksi oksidasi)
Reaksi
redoks dapat dipahami sebagai transfer elektron dari salah satu senyawa (disebut
reduktor) ke senyawa lainnya (disebut
oksidator). Dalam proses ini, senyawa yang satu akan teroksidasi dan senyawa lainnya akan tereduksi, oleh karena itu disebut
redoks. Oksidasi sendiri dimengerti sebagai kenaikan
bilangan oksidasi, dan reduksi adalah penurunan
bilangan oksidasi.
Dalam prakteknya, transfer dari elektron ini akan selalu mengubah
bilangan oksidasinya, tapi banyak reaksi yang diklasifikasikan sebagai
reaksi redoks walaupun sebenarnya tidak ada elektron yang berpindah
(seperti yang melibatkan ikatan
kovalen).
[9][10]
Contoh reaksi redoks adalah:
- 2 S2O32−(aq) + I2(aq) → S4O62−(aq) + 2 I−(aq)
- Yang mana I2 direduksi menjadi I- dan S2O32- (anion tiosulfat) dioksidasi menjadi S4O62-.
Untuk mengetahui reaktan mana yang akan menjadi agen pereduksi dan mana yang akan menjadi agen teroksidasi dapat diketahui dari
keelektronegatifan elemen tersebut. Elemen yang mempunyai nilai keelektronegatifan yang rendah, seperti kebanyakan unsur
logam,
maka akan dengan mudah memberikan elektron mereka dan teroksidasi -
elemen ini menjadi reduktor. Kebalikannya, banyak ion mempunyai bilangan
oksidasi tinggi, seperti
H2O2,
MnO4-,
CrO3,
Cr2O72-,
OsO4) dapat memperoleh satu atau lebih tambahan elektron, sehingga disebut oksidator.
Jumlah elektron yang diberikan atau diterima pada reaksi redoks dapat diketahui dari
konfigurasi elektronn elemen reaktannya. Setiap elemen akan berusaha untuk menjadikan konfigurasi elektronnya sama seperti konfigurasi elemen
gas mulia.
Logam alkali dan halogen akan memberikan dan menerima satu elektron.
Elemen gas alam sendiri sebenarnya tidak aktif secara kimiawi.
[11]
Salah satu bagian penting dalam reaksi redoks adalah reaksi
elektrokimia,
dimana elektron dari sumber listrik digunakan sebagai reduktor. Reaksi
ini penting untuk pembuatan elemen-elemen kimia, seperti
klorin[12] atau
aluminium. Proses kebalikan dimana reaksi redoks digunakan untuk menghasilkan listrik juga ada dan prinsip ini digunakan pada
baterai.
[sunting] Reaksi asam-basa
Reaksi asam-basa adalah reaksi yang mendonorkan proton dari sebuah molekul
asam ke molekul
basa. Disini,
asam berperan sebagai donor proton dan
basa berperan sebagai akseptor proton.

- Reaksi asam basa, HA: asam, B: Basa, A–: basa konjugasi, HB+: asam konjugasi
Hasil dari transfer proton ini adalah
asam konjugasi dan
basa konjugasi.
[13]
Reaksi kesetimbangan (bolak-balik) juga ada, dan karena itu asam/basa
dan asam/basa konjugasinya selalu dalam kesetimbangan. Reaksi
kesetimbangan ini ditandai dengan adanya
konstanta diasosiasi asam dan basa (
Ka dan
Kb) dari setiap substansinya. Sebuah reaksi yang khusus dari reaksi asam-basa adalah
netralisasi dimana asam dan basa dalam jumlah yang sama akan membentuk
garam yang sifatnya netral.
Reaksi asam basa memiliki berbagai definisi tergantung pada konsep asam
basa yang digunakan. Beberapa definisi yang paling umum adalah:
-
- Definisi Arrhenius: asam berdisosiasi dalam air melepaskan ion H3O+; basa berdisosiasi dalam air melepaskan ion OH-.
- Definisi Brønsted-Lowry: Asam adalah pendonor proton (H+) donors; basa adalah penerima (akseptor) proton. Melingkupi definisi Arrhenius
- Definisi Lewis:
Asam adalah akseptor pasangan elektron; basa adalah pendonor pasangan
elektron. Definisi ini melingkupi definisi Brønsted-Lowry.
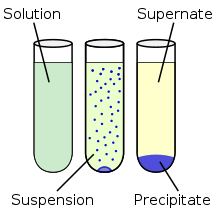
Presipitasi
adalah proses reaksi terbentuknya padatan (endapan) di dalam sebuah
larutan sebagai hasil dari reaksi kimia. Presipitasi ini biasanya
terbentuk ketika konsentrasi ion yang larut telah mencapai batas
kelarutan[14] dan hasilnya adalah membentuk
garam.
Reaksi ini dapat dipercepat dengan menambahkan agen presipitasi atau
mengurangi pelarutnya. Reaksi presipitasi yang cepat akan menghasilkan
residu mikrokristalin dan proses yang lambat akan menghasilkan
kristal tunggal. Kristal tunggal juga dapat diperoleh dari
rekristalisasi dari garam mikrokristalin.
[15]
[sunting] Reaksi dalam kimia organik
Dalam kimia organik, banyak reaksi yang dapat terjadi yang melibatkan
ikatan kovalen diantara atom karbon dan heteroatom lainnya seperti
oksigen,
nitrogen, atau atom-atom
halogen lainn

 orbital
s-p membentuk ikatan sigma
orbital
s-p membentuk ikatan sigma orbital
p-p membentuk ikatan sigma
orbital
p-p membentuk ikatan sigma