KIMIA NUKLIR ATAU KIMIA INTI
Inti dari beberapa atom adalah radio aktif, artinya unsur tersebut tidak stabil dan akan mengalami peluruhan karena waktu.
Hampir seluruh unsur yang mempunyai bentuk yang tidak stabil disebut radio ISOTOP.
Saat radio isotop meluruh akan mengeluarkan tiga jenis radiasi :
Sinar alfa, sinar beta dan sinar gamma, ketiga radiasi ini sangat berbahaya.
Kekuatan daya tembusnya :
Sinar γ lebih kuat dari sinar β daan sinar β lebih kuat dari sinar α.
Perbedaan lainnya :
Sinar α dan sinar β merupakan partikel, yaitu sinar α sama dengan unsur Helium sedangkan sinar β sama dengan partikel elektron.
Sedangkan sinar γ, merupkan radiasi elektromagnetik atau radiasi yang memiliki foton.
Kekuatan daya tembus digambarkan sebagai berikut :
Jika sebuah partikel radio aktif masuk kedalam alat pencacah Geiger, akan menyebabkan sedikit pulsa arus listrik mengalir.
Kekuatan radioaktivitas pada cuplikan dihitung dari banyaknya pulsa.
Satuan dari radioaktifitas :
Unit SI dinyatakan dengan BaCq uerel (Bq) adalah jumlah inti yang pecah setiap detik.
Begitu inti dari sebuah radioisotop pecah,
sejumlah partikel yang diikatnya lepas dan menjadi unsur yang berbeda.
Proses ini berlangsung terus sampai menjadi inti stabil, urutan kejadian
seperti ini disebut rangkaian peluruhan.
Berbagai reaksi yang terjadi dalam inti adalah reaksi fisi dan reaksi fusi.
Reaksi fisi : adalah reaksi, dimana terjadi
pemecahan dalam netron, terbagi dua, netron yang terbelah terbagi dua
lagi dan seterusnya.
Contoh :
Pemecahan pada uranium dengan ditambah netron.
Pada reaksi transmutasi, suatu unsur ditembaki dengan suatu partikel dengan energi yang sangat tinggi dan menghasikan unsur baru dan mengemisikan partikel lainnya, dengan menghasilkan unsur baru yang lebih stabil dan energi yang lebih besar. Pada peristiwa ini dapat terbentuk unsur yang tidak stabil terlebih dahulu.
Proses-proses diatas dilakukan dengan suatu alat seperti Cyclotron, Betatron atau Accelerator linier.
Reaksi fisi terjadi pada pembentukan PLTN (pembangkit Listrik Tenaga Nuklir) dan bom atom.
Reaksi fusi :
Adalah reaksi pembentukan, dari 2 inti menjadi inti yanglebih besar.
Reaksi fusi terjadi pada matahari dan bintang-bintang yang potensial sebagai suber energi. Juga pada pembentukan bom hydrogen.
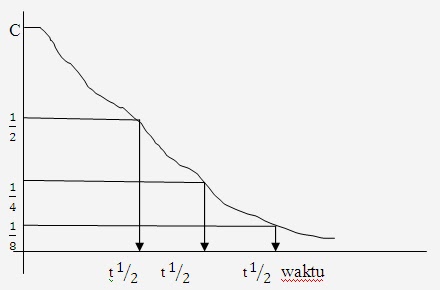
Waktu paruh (t 1:2) adalah: waktu yang diperlukan oleh inti zat radioisotop untuk meluruh, sehingga konsentrasi tinggal separuhnya atau setengahnya.
Artinya saat meluruh pertama tinggal separuhnya,
meluruh kedua tinggal seperempatnya, meluruh ketiga tinggal seperdelapan
dan seterusnya.
Tiap zat radioisotop memiliki waktu paruh yang berbeda-beda.
Bentuk grafik di gambarkan sebagai berikut :
Waktu paruh dari radioisotop.
Kestabilan Unsur Nuklir
Dari percobaan-percobaan setiap unsur dengan nomor atom lebih
besar dari 83 (bismuth) bersifat radioaktif dan merupakan ISOTOP-ISOTOP yang tidak stabil. Tetapi unsur-unsur yang lebih ringan, kecuali untuk Technetium (z=43) dan Promethium (z=61), memiliki satu atau lebih unsur yang stabil dan tidak radioaktif. ISOTOP-ISOTOP yang bersifat radioaktif akan berusaha menjadi ISOTOP yang stabil dengan cara transformasi.
besar dari 83 (bismuth) bersifat radioaktif dan merupakan ISOTOP-ISOTOP yang tidak stabil. Tetapi unsur-unsur yang lebih ringan, kecuali untuk Technetium (z=43) dan Promethium (z=61), memiliki satu atau lebih unsur yang stabil dan tidak radioaktif. ISOTOP-ISOTOP yang bersifat radioaktif akan berusaha menjadi ISOTOP yang stabil dengan cara transformasi.
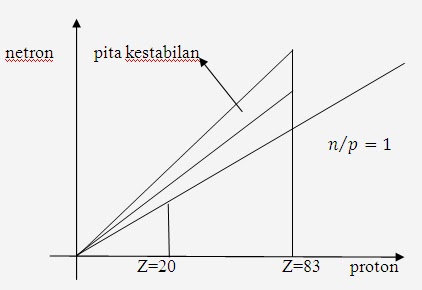
Berikut
ini, suatu grafik yang memperlihatkan letak pita kestabilan, yaitu
proton sebagai absis dan jumlah netron sebagai ordinat.
Dari gambar diatas, bila unsur dengan proton ebih kecil dari 20, termasuk ISOTOP yang stabil, dan unsur yang stabil, bia perbandingan netron terhadap netron mendekati 1. Sehingga dapat dijelaskan ISOTOP karbon (14) tidak stabil dan isotop tersebut berubah menjadi unsur lain (nitrogen), yang lebih stabil dengan mengemisikan electron.
Cara lainnya dari ISOTOP untuk mencapai kestabilan, yaitu dengan mengemisikan netron seperti pada ISOTOP Iodium.
Unsur
yang dibawah pita kestabilan harus meningkatkan nilai n/p untuk mencapa
kestabilan, yaitu dengan mengemisikan positron (elektron dengan muatan
positif).
Cara kedua meningkatkan nilai n/p
yang disebut elektron capture atau K-cature, yaitu melepaskan elektron
pada kulit terluar atau terjadi transformasi dari proton menjadi netron.
Pada unsur dengan nomor atom lebih dari 83, untuk mencapai ISOTOP yang leih stabil, yaitu dengan cara mengemisikan sinar alfa (Helium), seperti terjadi pada uranium.
Pengoprasian Suatu Cyclotron
Gambar 1
Salah Satu Dampak Dari Energi Nuklir
Gambar 2
Perhitungan energi dalam kimia nuklir
Dalam suatu inti atom terdiri dari proton dan netron, menurut einsten ada hubungan antara energi dengan massa, yang dinyatakan dengan rumus :
terikat Ada jumlah energi yang dapat digunakan untuk menguraikan atau melepaskan ikatan pada inti-inti nuklir dan ada juga energi yang dapat dipakai untuk mengikat inti-inti atom sehingga kuat, energi demikian disebut energi ikatan.
Proton (p) 1,007277 unit (sma)
Netron (n) 1,0088665 unit (sma)
Elektron (e) 0,0005486 (sma)
Bila dihitung massa dari unsur Helium :
(2x1,007277)
+ (2x1,008665) + (2x0,0005486) = 4,032981 unit (sma), angka ini hasil
perhitungan sedangkan dari hasil pengukuran dengan spektrofotometri
adalah 4,002603 unit.
Ada selisih : 4,032981-4,002603 unit = 0,0030378 unit.
Artinya
dalam Helium dengan kandungan 2 buah proton dan 2 buah netron, sejumlah
0,030378 unit, dikonversikan menjadi energi, 0,030378 g atau 3,0378 x
kg.
Bandingkan bila dibakar 1 mol gas CH (metan) akan dibebaskan sejumlah 8,9x10 kj.
Jadi energi dari 1 mol Helium lebih besar daripada 1 mol gas metan (CH).



























0 komentar:
Posting Komentar